(Χημεία)
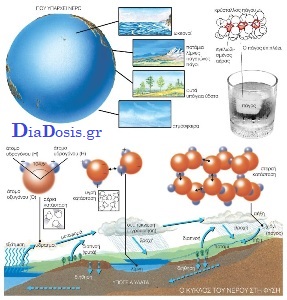
Ανόργανη ένωση με χημικό τύπο H2O και μοριακό βάρος 18. Είναι η πιο κοινή και πιο διαδομένη ένωση στη φύση είτε σε υγρή είτε σε στερεή (πάγος, χιόνι) είτε σε αέρια κατάσταση (υδρατμοί). Είναι το μοναδικό διαλυτικό μέσο των διάφορων κυτταρικών[GLi] και εξω-κυτταρικών υγρών, ενώ αποτελεί βασικό συστατικό όλων των τροφίμων ζωικής και φυτικής προέλευσης. Συμμετέχει ενεργά στην κρυσταλλική δομή πολλών αλάτων (κρυσταλλικό νερό) απ’ όπου απομακρύνεται με παρατεταμένη θέρμανση στους 105°C.
Ως το 18ο αιώνα πίστευαν ότι το νερό είναι στοιχείο. Το 1781 ο Κάβεντις ανακάλυψε ότι παράγεται κατά την καύση υδρογόνου στον αέρα, ενώ την ακριβή σύστασή του βρήκε ο Λαβουαζιέ. Στη σύγχρονη εποχή είναι γνωστό ότι το νερό αποτελείται από υδρογόνο και οξυγόνο σε αναλογία βάρους 1:8 ή σε αναλογία όγκου 1:2, γεγονός που αποδεικνύεται εύκολα είτε με σύνθεση σε ειδική συσκευή, το ευδιόμετρο, είτε με ηλεκτρόλυση νερού που περιέχει λίγο θειικό οξύ.
Το νερό όμως που υπάρχει στη φύση, είτε παραμένει στάσιμο (λίμνες) είτε κινείται (υπόγεια ρεύματα, ποτάμια), δεν είναι χημικά καθαρό, αλλά περιέχει πάρα πολλά ξένα σώματα. Αυτά είτε θα αιωρούνται μέσα στο νερό είτε θα είναι διαλυμένα. Από τα αιωρούμενα σώματα μπορεί να καθαριστεί με φιλτράρισμα. Στα δίκτυα ύδρευσης των πόλεων, όπου πρέπει να φιλτραριστούν μεγάλες ποσότητες, χρησιμοποιούνται αλλεπάλληλα στρώματα από άμμο, χαλίκια και πορώδη ξυλάνθρακα.
Οι διαλυμένες στο νερό ουσίες είναι συνήθως διάφορα άλατα που συνιστούν τη σκληρότητα του νερού.
Από αυτά τα άλατα το Μg(ΗCΟ3)2 και Ca(ΗCΟ)2, όταν θερμανθούν, μετασχηματίζονται σε αδιάλυτα MgCΟ3 και CaCΟ3 και μπορούν με φιλτράρισμα να απομακρυνθούν.[GLi] Για το λόγο αυτόν η σκληρότητα που οφείλεται σ’ αυτά ονομάζεται παροδική σκληρότητα. Όλα τα άλλα άλατα (συνήθως χλωριούχα και θειικά άλατα του ασβεστίου και μαγνησίου) συνιστούν τη μόνιμη σκληρότητα.
Η ύπαρξη αυτών των αλάτων στο νερό έχει ως συνέπεια:
α) τη βαθμιαία απόθεσή τους στα τοιχώματα των δοχείων όπου αυτό θερμαίνεται, με αποτέλεσμα το στρώμα των αλάτων, γνωστό με την ονομασία πουρί, να παρεμποδίζει την κυκλοφορία του νερού ή την ανταλλαγή θερμότητας διαμέσου των σωληνώσεων στις βιομηχανικές εγκαταστάσεις, και
β) το σχηματισμό αδιάλυτων αλάτων παλμιτικού στεατικού ή ελαϊκού ασβεστίου ή μαγνησίου, με αποτέλεσμα να μη μένει σαπούνι διαλυμένο στο νερό και έτσι να μην μπορεί να αναπτυχθεί η απορρυπαντική δράση του σαπουνιού.
Γι’ αυτό τα άλατα απομακρύνονται με διάφορες χημικές κατεργασίες, που λέγονται αποσκλήρυνση.
Η αποσκλήρυνση γίνεται είτε με το σχηματισμό αδιάλυτων αλάτων είτε με την ανταλλαγή των ιόντων. Αυτή γινόταν παλιότερα από ειδικά πετρώματα, από τα οποία γνωστότερα είναι ο περμουτίτης, και περιοριζόταν στην ανταλλαγή ιόντων Ca++ και Mg++ από ιόντα Na+. Στη[GLi] σύγχρονη εποχή γίνεται από ειδικές ρητίνες, τις ιοντοανταλλακτικές ρητίνες, που ανταλλάσσουν όλα τα κατιόντα με Η+ και όλα τα ανιόντα με ΟΗ–, τα οποία ενώνονται προς νερό Η+ + ΟΗ–→Η2Ο. Το νερό που παίρνουμε μ’ αυτό τον τρόπο ονομάζεται απιονισμένο και είναι ανάλογο με το αποσταγμένο. Χρησιμοποιείται σε βιομηχανικές εγκαταστάσεις και σε εργαστήρια, είναι όμως ακατάλληλο για πόση, γιατί προκαλεί αιμόλυση.
Πρέπει να τονιστεί ότι δεν επιδιώκεται πάντα η απομάκρυνση των αλάτων που είναι σε διάλυση. Πολλές φορές το νερό περιέχει άλατα που του δίνουν θεραπευτικές ιδιότητες. Οι πηγές απ’ όπου αναβλύζει αυτό το νερό λέγονται ιαματικές πηγές. Αν η θερμοκρασία του νερού είναι ψηλότερη από τη μέση θερμοκρασία του τόπου, τότε λέγονται θερμές πηγές. Άλατα επίσης πρέπει να περιέχει σε μικρή ποσότητα το πόσιμο νερό, όπως προαναφέρθηκε, το οποίο πρέπει ακόμα να είναι διαυγές, άοσμο, χωρίς χρώμα και δροσερό (7°-11°C). Στο πόσιμο νερό είναι απαραίτητος και ο βακτηριολογικός και μικροβιολογικός έλεγχος.
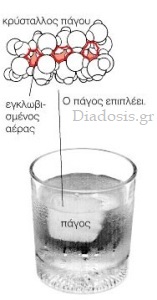
Το νερό είναι γνωστό και στις τρεις καταστάσεις της ύλης (στερεή, υγρή και αέρια).
Τα σημεία τήξης και ζέσης του νερού χρησιμοποιήθηκαν ως βάση για τη βαθμολόγηση των θερμομέτρων.
Έτσι στην κλίμακα Κελσίου το σημείο πήξης του πάγου αντιστοιχεί στο 0, ενώ το σημείο ζέσης του νερού στο 100.
Αξιοσημείωτη είναι η ανωμαλία που παρουσιάζει το νερό στη μεταβολή της πυκνότητάς του με τη θερμοκρασία. Έτσι, ενώ σ’ όλα τα σώματα η πυκνότητα αυξάνεται όσο ελαττώνεται η θερμοκρασία, στο νερό αυτό συμβαίνει ως τους 4°C, οπότε και αποκτά τη μεγαλύτερή του πυκνότητα 1 gr/cm3.
Η σπουδαιότερη χημική ιδιότητα του νερού είναι η ικανότητά του να διαλύει μεγάλο αριθμό ουσιών, κυρίως ανόργανων. Αυτό οφείλεται στη μεγάλη διπολική ροπή του μορίου του. Ενώνεται με βασικά και όξινα οξείδια και δίνει αντίστοιχα βάσεις ή οξέα.
Διασπά διάφορες ουσίες, κυρίως άλατα.
Τέλος εν θερμώ διασπάται από ελεύθερα στοιχεία (Fe, C) τα οποία οξειδώνει.
Εκτός από τις συνήθεις χρήσεις του (πόσιμο, μέσο καθαριότητας), χρησιμοποιείται ως μέσο μεταφοράς θερμότητας και ως άριστο διαλυτικό.
Αν αντί του κανονικού υδρογόνου (με μαζικό αριθμό 1) χρησιμοποιηθεί το δευτέριο (ισότοπο του υδρογόνου με μαζικό αριθμό 2) ή το τρίτιο (ισότοπο με μαζικό αριθμό 3), παίρνουμε αντίστοιχα το[GLi] βαρύ και υπερβαρύ νερό. Το βαρύ νερό υπάρχει στο φυσικό νερό σε αναλογία 1:6.000 περίπου και διαχωρίζεται με εξαντλητική ηλεκτρόλυση.
Το βαρύ νερό χρησιμοποιείται στους πυρηνικούς αντιδραστήρες.